生信分析+下游驗證,發到了頂刊11.4,現在還是紅利期,趕緊行動起來吧!
題目:泛癌分析揭示乳酸代謝在免疫治療反應預測和生存預測新的見解
英文名:Pan-cancer analysis implicates novel insights of lactate metabolism into immunotherapy response prediction and survival prognostication
雜志:Journal of Experimental & Clinical Cancer Research
影響因子:11.4
研究背景:免疫療法已經成為一種有效的臨床癌癥治療方法,靶向腫瘤細胞中的乳酸代謝(LM)作為增強抗腫瘤免疫反應的方法是一種有前景的治療策略。作者利用scRNA-seq數據和多種機器學習(ML)算法,在泛癌水平上揭示了LM和免疫治療耐藥性之間的緊密相關性,并進一步建立了一種新的LM相關特征基因集(LM. SIG),為患者選擇合適的免疫治療提供了參考。
研究思路:


圖1
作者首先在兩個免疫療法scRNA-seq數據集中說明并驗證了LM與免疫治療反應之間是存在負相關的。隨后,基于40個泛癌scRNA-seq隊列建立了LM相關特征基因集(LM.SIG),然后,基于8個免疫治療轉錄組隊列和30個癌癥基因組圖譜(TCGA)泛癌數據集,采用15種機器學習(ML)算法來驗證LM.SIG在免疫治療反應預測和生存預測方面的能力。此外,作者還基于17個CRISPR數據集,篩選了免疫治療潛在的靶點,通過下游實驗在胰腺癌類器官中進行了驗證。
研究結果:
1、 LM上調與免疫治療耐藥相關
作者對2個免疫治療的scRNA-seq數據集進行分析,計算LM的相關基因的得分,結果表明,LM水平升高的惡性細胞在無應答(NR)組內表現出富集(圖2A),這個結果在另一個數據集得到驗證(圖2C-D),這些結果共同表明LM與免疫治療耐藥有關。
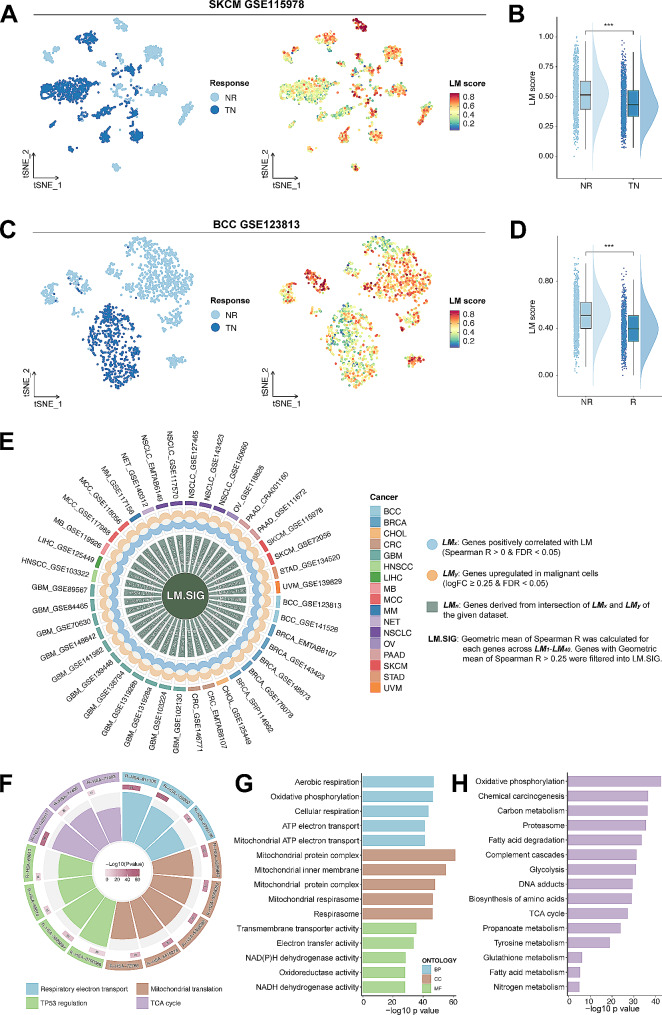

圖2
2、 使用泛癌scRNA-seq隊列建立LM. SIG
作者利用泛癌scRNA-seq隊列數據,進行GSVA分析,篩選與LM相關基因的基因集:LMx(與LM呈正相關的基因)、LMy(惡性細胞中上調的基因),取交集得到LMn。計算LM1-LM40的單個基因的Spearman相關系數(R)的幾何平均值,超過0.25的基因收集到LM SIG中,共有84個基因(圖2E)。基于Reactome(圖2F)、GO(圖2G)和KEGG(圖2H)對這84個基因注釋,結果表明,LM. SIG主要富含乳酸代謝相關和致瘤途徑,如煙酰胺腺嘌呤二核苷酸(NADH)相關途徑、三羧酸(TCA)循環相關途徑和TP53調節,有幾個基因被報道與免疫活性相關,如C1QBP、TUFM、LDHA、LDHB和ACAT1。
3、基于泛癌TCGA隊列的LM. SIG免疫圖譜
在基因層面,作者比較了LM.SIG與不同癌癥類型免疫相關基因表達水平之間的相關性,LM.SIG評分與這些基因的表達之間存在顯著負相關(圖3A)。細胞層面,高LM.SIG評分的腫瘤減少了抗腫瘤免疫細胞的浸潤,包括NK細胞和細胞毒性淋巴細胞(圖3B)。在通路上,高LM. SIG評分的患者中排名靠前的通路有氧化磷酸化、活性氧途徑、DNA修復和MYC靶向通路等(圖3C)。因此,獲得較低LM.SIG的患者往往比獲得較高LM.SIG的患者獲得更好的抗腫瘤免疫。
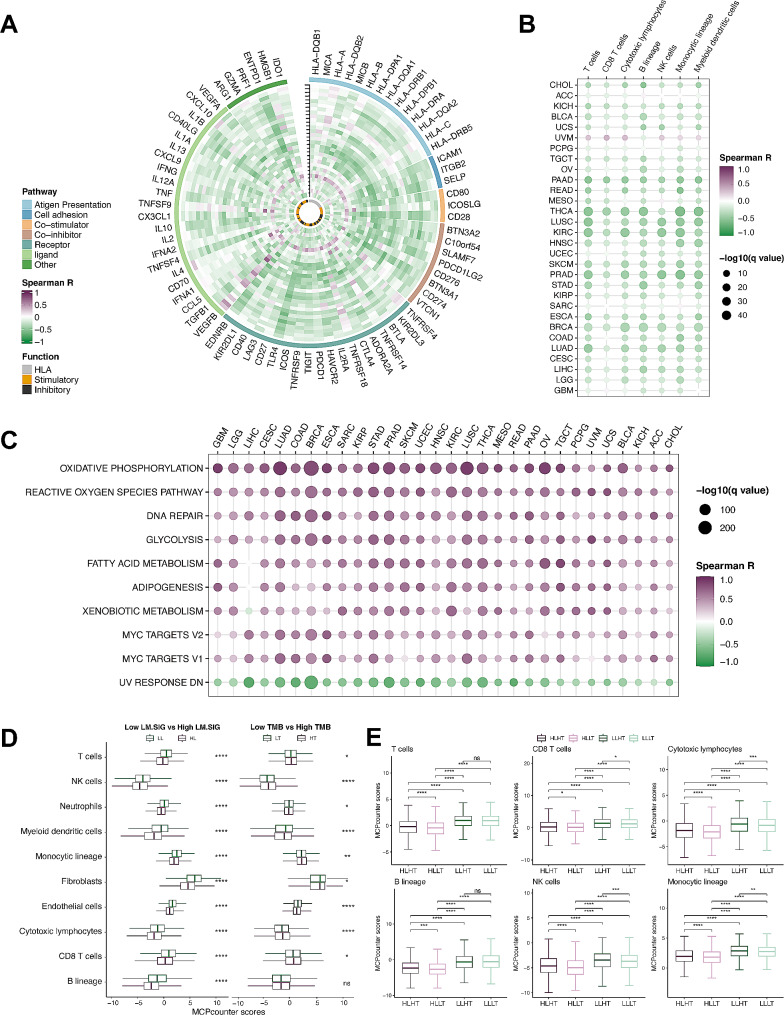

圖3
4、LM.SIG的免疫治療反應預測
將8個臨床信息完整的免疫治療數據集,分類為訓練集(n=618)、驗證集(n=154)和測試集(n=79)(圖4A)。使用7種機器學習算法訓練模型,并迭代10次重復5倍交叉驗證,計算AUC值,確定best的LM.SIG模型(圖4B-C)。隨后進行了一系列測試,證明了LM.SIG在預測泛癌數據集中免疫治療反應的能力。
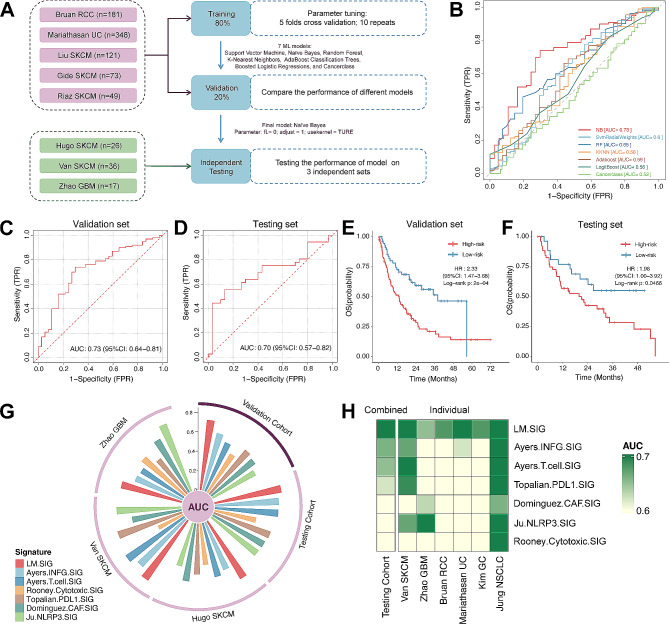

圖4
5、LM.SIG 的生存預測
為了調整LM.SIG對泛癌生存率的預測,作者開發了一種基于SurvBenchmark設計的生存模型。評估了各種生存特異性模型,利用TCGA泛癌患者數據集訓練LM.SIG預后模型,MTLR_GA并被確定為best模型(圖5A)。
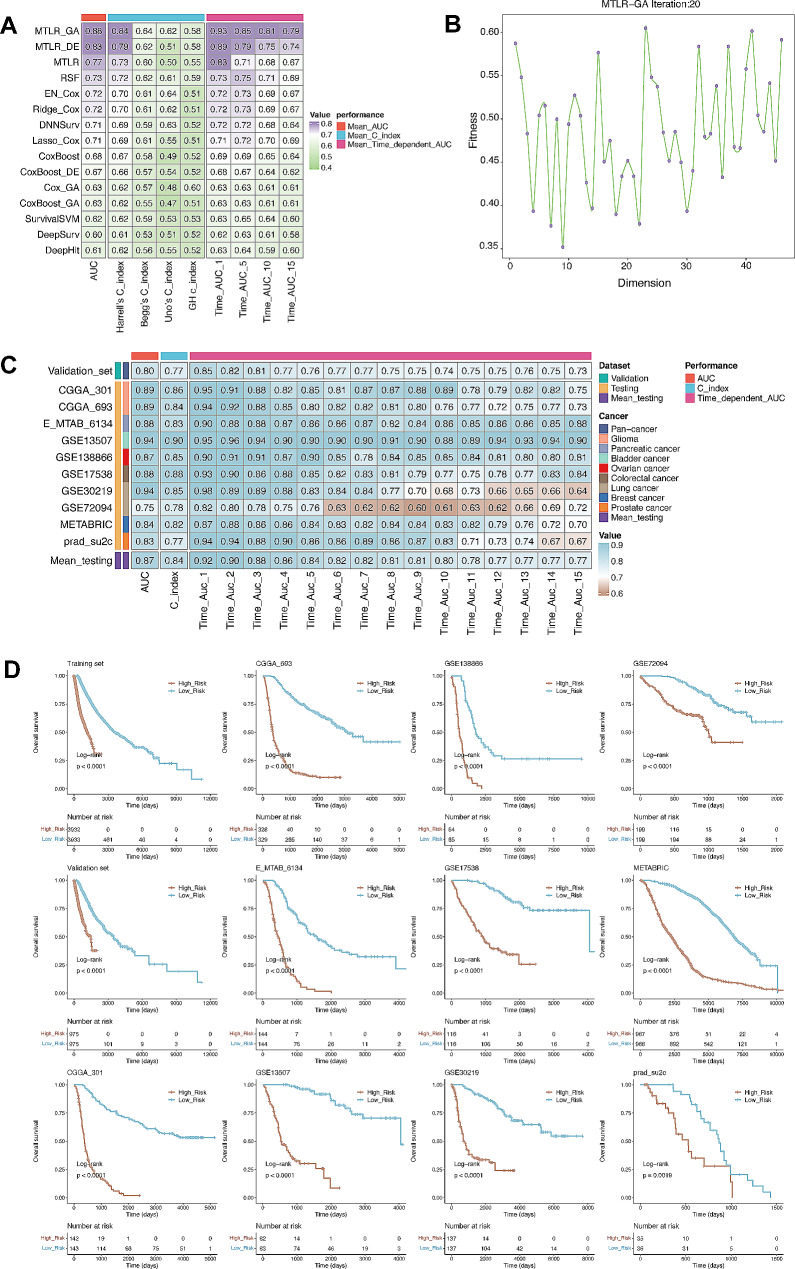

圖5
6、使用CRISPR研究從LM. SIG產生的潛在治療靶點
從7項CRISPR研究中提取17個CRISPR數據集,CRISPR基因中z評分排名靠前的基因被視為免疫抵抗基因(圖6A)。LM.SIG占排名靠前的基因的比例高于其他特征(圖6B-C)。為了進一步研究具有免疫治療預測和生存預測的靶點,將19個CRISPR集中的基因和10個LM. SIG預后模型相關的基因取交集,得到靶點基因LDHA(圖6D)。LDHA基因的顯著性也在TCGA泛癌數據集和3個隊列數據集中得到驗證(圖6E-G)。
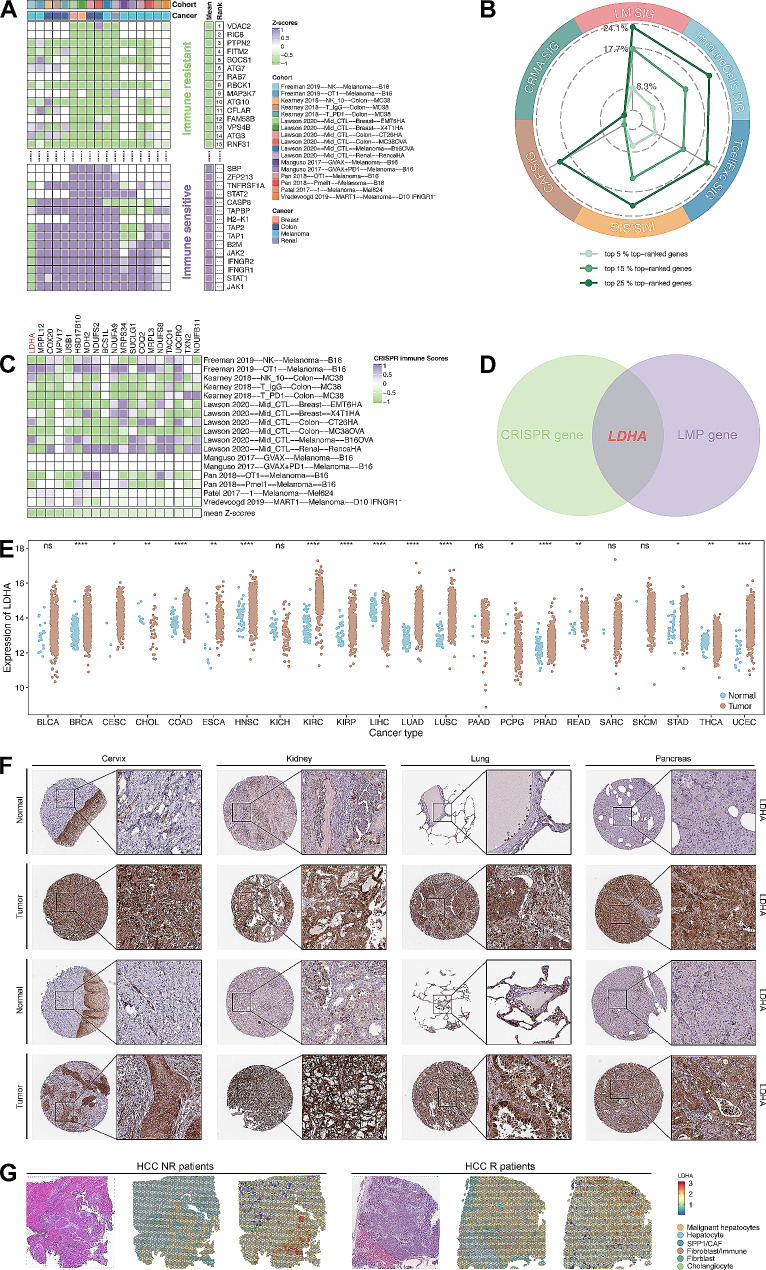
圖 6
7、LDHA缺乏增強胰腺癌的抗腫瘤免疫和免疫治療反應
從患者外周血中分離CD8+T細胞和CD14+單核巨噬細胞,體外M-CSF激活并與sh-NC 或 sh-LDHA胰腺癌類器官共培養(圖7A)。顯微鏡觀察和細胞活力檢測顯示,LDHA的敲除顯著地減慢了類器官的生長速度(圖7B)。通過IHC染色,在sh-LDHA 類器官中也觀察到Ki-67的低表達(圖7C)。同時,分析共培養系統中的CD8+T細胞和巨噬細胞。RT-qPCR結果顯示,共培養時,T細胞殺傷基因和免疫檢查點基因(IFNG、GZMB、PDCD1和CTLA4)的表達顯著升高,而巨噬細胞M2相關標志物(CD206、CD163、TGFB和ARG1)的表達降低,M1相關標志物(IL1A、IL1B和CD80)的表達增加(圖7D)。這些結果表明sh-LDHA 的類器官中巨噬細胞從原瘤轉向抗腫瘤。此外,流式細胞術分析顯示sh-LDHA組的CD8+T細胞具有更強的抗腫瘤活性和增殖能力(圖7E-G),巨噬細胞更傾向于抗腫瘤M1極化(圖7H-K)。用KPC細胞(sh-NC和sh-LDHA)注射到小鼠的腹部外側產生皮下腫瘤,并在第9、12和15天腹腔注射抗IgG或抗PD1(圖7L)。與sh-NC組相比,sh-LDHA組抗PD1治療效果更顯著,腫瘤減少更明顯(圖7M,N)。IHC結果還表明,sh-LDHA的腫瘤具有豐富的免疫細胞浸潤和較慢的腫瘤增殖(圖7O)。實驗結果表明,LDHA影響免疫細胞的狀態,低表達的LDHA提高了它們在胰腺癌免疫治療中的療效。

 圖 7
圖 7




