網絡藥理學+分子對接+實驗驗證,揭示了羅漢松樹脂素在前列腺癌中的抗轉移潛力
題目:新型系統生物學實驗流水線揭示了羅漢松樹脂素在前列腺癌中的抗轉移潛力:網絡藥理學、生物信息學和實驗驗證的綜合方法
英文名:Novel systems biology experimental pipeline reveals matairesinol’s antimetastatic potential in prostate cancer: an integrated approach of network pharmacology, bioinformatics, and experimental validation
雜志:Briefings in Bioinformatics
影響因子:Q1/6.8
發表時間:2024年9月5號
研究背景:羅漢松樹脂素(MAT)是一種植物木質素,因其在乳腺癌和前列腺癌等激素敏感性癌癥中的抗癌特性而聞名,在治療轉移性前列腺癌(mPC)方面提供了一條有前景但未被充分開發的途徑。
研究思路:為了闡明其特定的治療靶點和機制,采用網絡藥理學(NP)、生物信息學、基于基因MANIA的功能關聯(GMFA)和實驗驗證融為一體研究方法。通過挖掘在線數據庫,發現了27個mPC和MAT的共同靶點,通過STRING構建了MAT-mPC蛋白-蛋白相互作用網絡,并利用CytoHuba確定了11個中心靶點,如EGFR、AKT1、ERBB2、MET、IGF1、CASP3、HSP90AA1、HIF1A、MMP2、HGF和MMP9。利用DAVID,GO分析強調了轉移相關過程,如上皮-間質轉化、細胞遷移的正調控,以及關鍵的KEGG通路分析,包括癌癥、前列腺癌、PI3K-Akt和MAPK信號轉導,而UALCAN和GEPIA2等數據庫鑒定了前11個中心靶點在mPC患者生存分析和基因表達模式中的臨床意義。運用一種新的富集方法(GMFA)進一步豐富了網絡藥理學研究結果。分子對接分析表明了MAT與11個中心靶點之間的實質性相互作用。模擬研究證實了MAT與選定靶點的穩定相互作用。利用RT-qPCR和各種基于細胞的檢測方法在PC3細胞中進行的實驗驗證證實了MAT對mPC的抗轉移作用。總的來說,進行了詳盡的NP分析,輔以GMFA、分子對接、分子動力學模擬和實驗驗證,強調了MAT在通過不同治療途徑靶向mPC方面的多方面作用。
研究結果:
1、構建PPI網絡并分析MAT針對mPC的前11個樞紐目標
采用了一種系統方法來預測針對mPC的MAT靶點。首先,從Swiss Target Prediction、Pharmapper和Superpred數據庫中檢索了MAT靶點,得出了524個潛在靶點。同時,還從GeneCards和DisGeNet數據庫中確定了mPC靶點,得出了236個靶點。交叉分析發現了MAT針對mPC的27個潛在治療靶點(PTM-mPC)(圖1A)。PPI網絡包括27個從mPC和MAT基因交叉點識別出的PTM-mPC中心靶標(圖1B)。該網絡有27個節點,163條邊,平均PPI富集P值小于1.0e-16,平均局部聚類系數為0.75,平均節點度為12.1。通過CytoHubba插件,Cytoscape分析進一步確定了前11個基因--EGFR、AKT1、ERBB2、MET、IGF1、CASP3、HSP90AA1、HIF1A、MMP2、HGF和MMP9(圖1C),這些基因按其程度算法得分排序,用顏色表示節點程度。
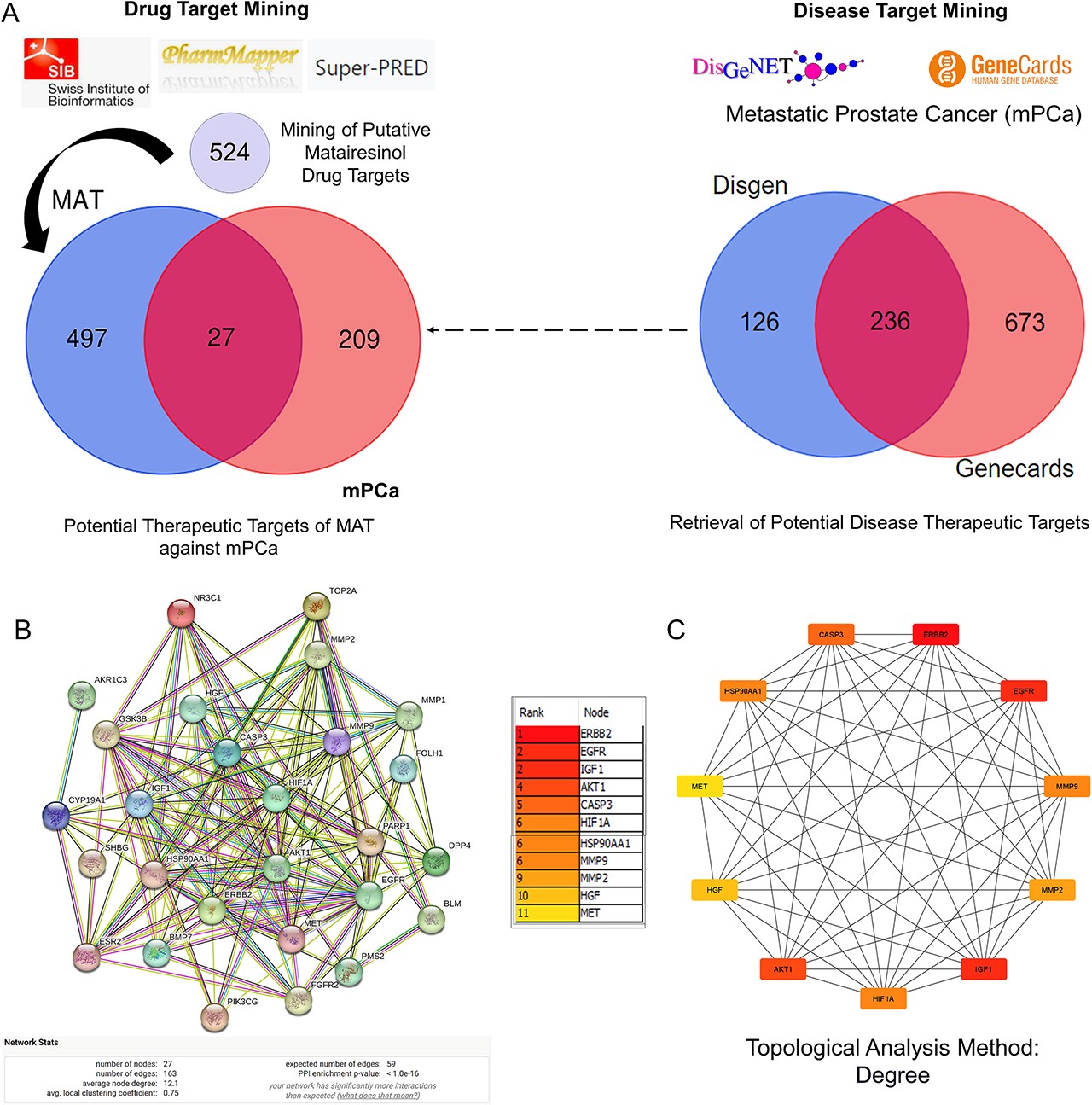
圖1
2、通路的富集分析和MAT靶向mPC的預測靶標的C-T-P網絡構建
利用DAVID分析了KEGG通路中的27條共同路徑,以了解MAT誘導的mPC進展改變。發現了36條通路(FDR≤0.05,P值≤0.05),前20條通路見圖2A。構建了一個“化合物-靶點-通路(C-T-P)”網絡(圖2B),以直觀顯示MAT、其目標和相關通路。值得注意的通路包括:癌癥中的通路、癌癥中的原茶聚糖、PI3K-Akt信號通路、MAPK信號通路、前列腺癌和表皮生長因子受體酪氨酸激酶抑制劑抗性。前列腺癌與8個基因密切相關,包括GSK3B、HSP90AA1、ERBB2、AKT1、IGF1、MMP9、表皮生長因子受體、和表皮生長因子受體2在C-T-P網絡中的作用,突顯了MAT與癌癥相關信號級聯之間的潛在聯系。利用DAVID進行的GO富集分析發現,150個BP、20個CC和35個MF術語的P值達到了≤0.05閾值。應用FDR過濾器(FDR≤0.05)得到34個BP項、3個CC項和16個MF項。圖2C顯示了前15個BP和MF術語以及3個CC術語。BP富集包括轉錄調控、信號轉導、細胞凋亡、細胞增殖和上皮-間質轉化等通路。CC術語表明基因存在于細胞膜和細胞外空間等細胞區域。MF分析顯示了一些關鍵功能,如如蛋白質結合、ATP結合和激酶活性。這項分析加深了人們對MAT對mPC治療作用的了解。
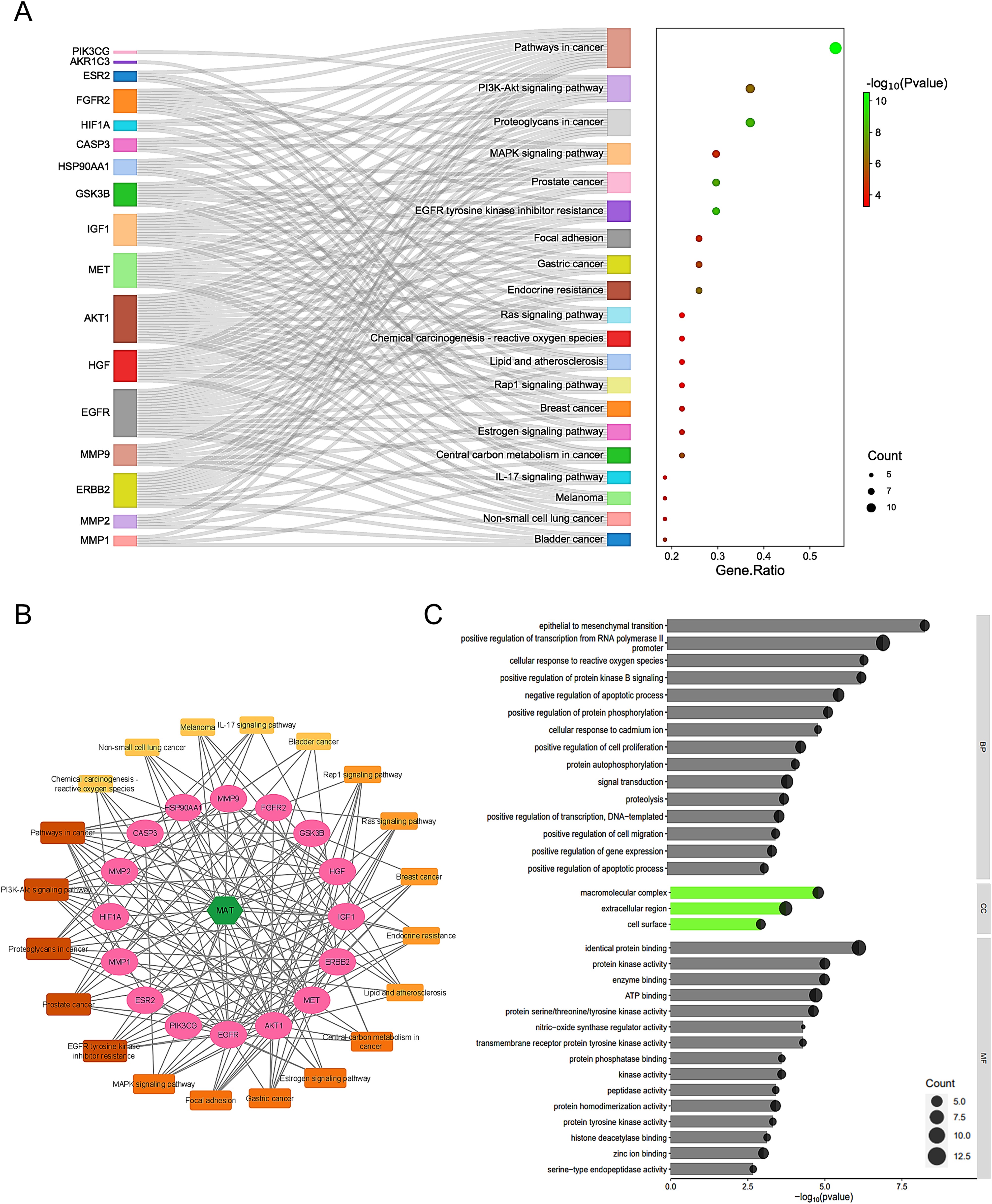

圖2
3、基因表達模式比較分析,重點關注MAT在正常組織和腫瘤組織中針對mPC的前11個樞紐靶點
利用UALCAN等公開數據集對前列腺腺癌患者的前11個樞紐靶點進行了基因表達分析。與正常組織相比,MMP-9、AKT1和CASP3在原發性腫瘤、高Gleason評分(6-10分)和轉移性結節中的表達明顯增加。此外,隨著格里森評分的升高,AKT1、ERBB2、HSP90AA1和MMP9的表達也呈上升趨勢,盡管AKT1和ERBB2在格里森評分為10時的表達有所下降(圖3)。這些發現揭示了樞紐靶點在不同前列腺腺癌進展階段的不同表達模式。
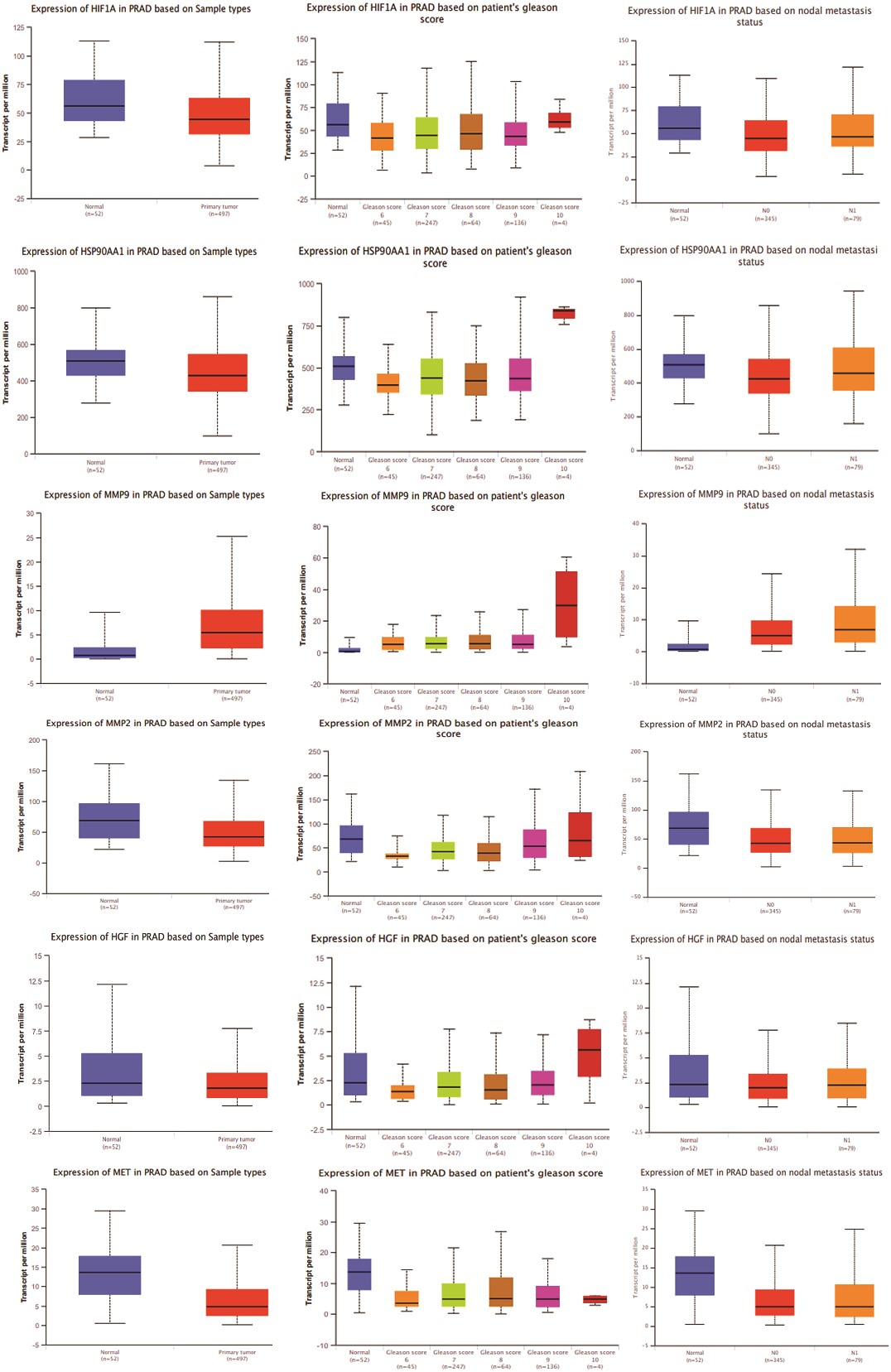

圖3
4、前列腺腺癌前11個樞紐基因的存活率分析:對患者預后和治療策略的影響
生存圖分析評估基因表達模式和患者生存結果,這對預后和治療策略至關重要。利用GEPIA2分析了前11個樞紐靶點的OS和無復發生存(RFS)概率(圖4)。生成中位數截斷值為50%且風險比為95%置信區間的圖。值得注意的是,在RFS分析中,HSP90AA1、MMP2、AKT1、CASP3和ERBB2的生存率隨著時間的延長而降低。相反,隨著前列腺癌的進展,HIF1A、HSP90AA1、AKT1、MMP9和ERBB2表達的升高會顯著降低總生存率。這些研究結果表明,中樞基因表達水平對前列腺癌患者的生存結果有重大影響。


圖4
5、MAT針對mPC的前11個樞紐靶標的分子對接和分子動力學模擬研究
通過分子對接,探索了MAT與前11個mPC靶點的相互作用,以了解它們的結合親和力和治療意義。觀察到MAT與ERBB2(-8.6)、AKT1(-8.5)、MMP-9(-8.4)、MET(-7.8)和表皮生長因子受體(EGFR)(-7.6)的結合能值較低,表明其具有較強的親和力。值得注意的是,MAT與酪氨酸激酶膜受體ERBB2、表皮生長因子受體EGFR和MET有很高的親和力,這表明它可能會抑制酪氨酸激酶的活性。此外,MAT與HSP90AA1和MMP-2的結合能分別為-7.1和-5.5 kcal/mol(圖5)。由于沒有合適的PDBID用于抑制位點的共晶體結合,作者進行了與IGF1R和MET(IGF1和HGF生長因子的受體)的對接分析。此外,還進行了MAT與CASP3的抑制劑XIAP的對接,以研究MAT對CASP3激活的可能調節作用,考慮到缺乏支持CASP3激活位點的合適PDBID,對接結合能(-6.1)。

圖5
根據它們在 mPC 中的結合親和力和生物學相關性,前5個樞紐靶標ERBB2、AKT1、MMP9、MET和EGFR進行MD模擬(圖6)。RMSD分析表明,與ERBB2-CL復合物(平均RMSD:0.5nm)相比,ERBB2-MAT復合物(平均RMSD:0.3nm)具有更好的穩定性。RMSF分析表明,MAT結合的ERBB2波動較小。ERBB2-MAT復合物的Rg保持穩定~2nm。AKT1-MAT。在50ns之前,RMSD比較穩定,但之后就出現了偏差。RMSF在AKT1-MAT的N端結構域波動較大。AKT1-MAT的Rg穩定在2.2nm。MMP9復合物顯示出相似的RMSDRMSF,Rg穩定在1.525nm。與MET-CL相比,MET-MAT的RMSD稍低,RMSF和穩定Rg相似。表皮生長因子受體復合物的RMSD和RMSF較高,穩定的Rg~2.2nm。CL與表皮生長因子受體形成了三個穩定的氫鍵,而MAT則偶爾形成氫鍵。

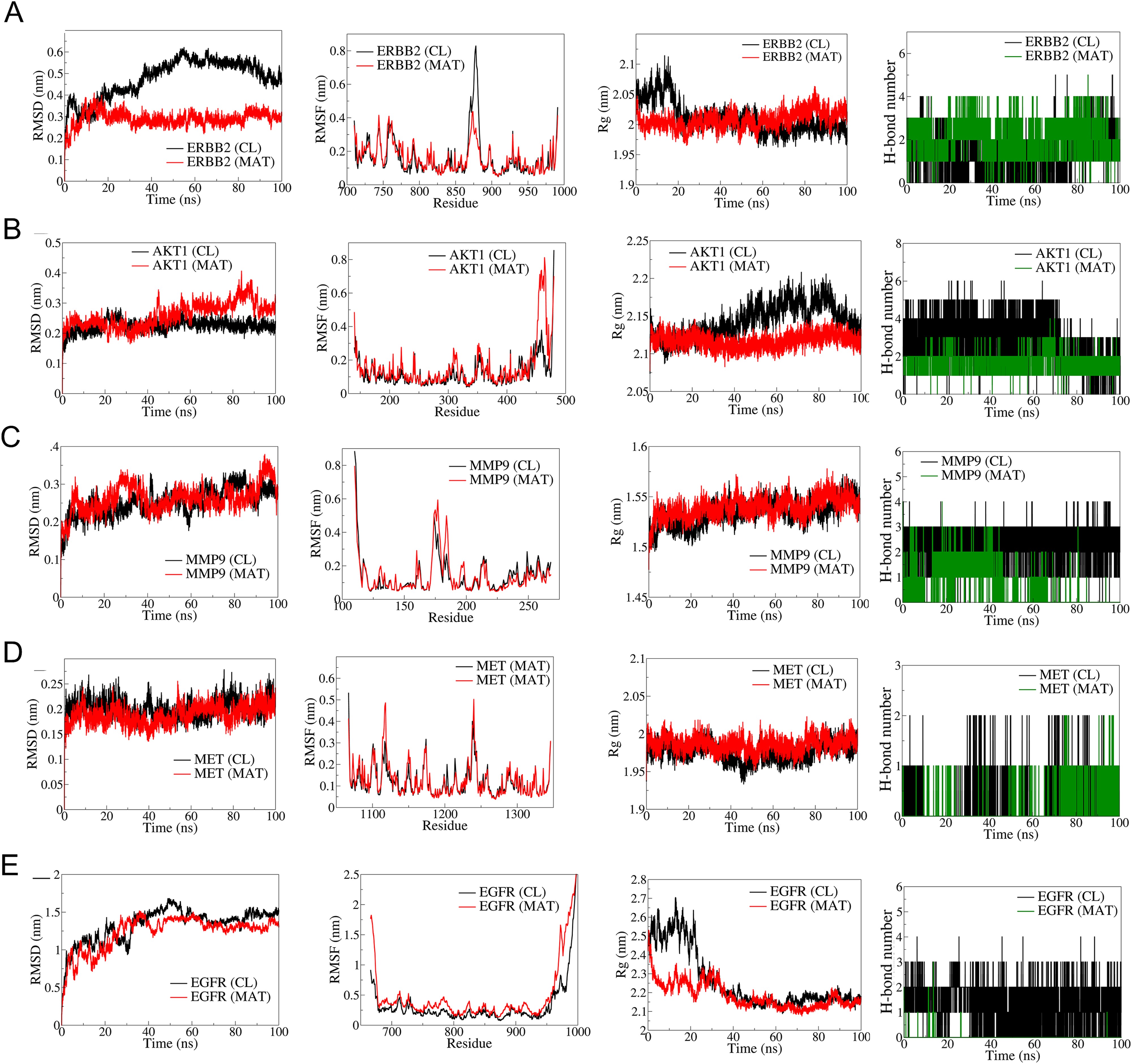
圖6
6、基于GeneMANIA的MAT針對mPC的前11個樞紐靶標的功能關聯網絡分析
作者利用他們之前建立的GeneMANIA分析方法,擴展了前11個中心目標基因列表,確定了每個中心靶點增加10個基因(圖7),從而形成GMFA擴展數據(GMFA-ED)。去除重復基因后,該數據集由112個基因組成,有助于進行全面的基因-基因相互作用分析。GMFA方法整合了共表達、遺傳相互作用和物理相互作用參數,以捕捉與疾病過程相關的各種基因。GMFA-ED在隨后的GO和KEGG富集分析中發揮了重要作用,為探索與已識別基因相關的功能意義奠定了堅實的基礎。
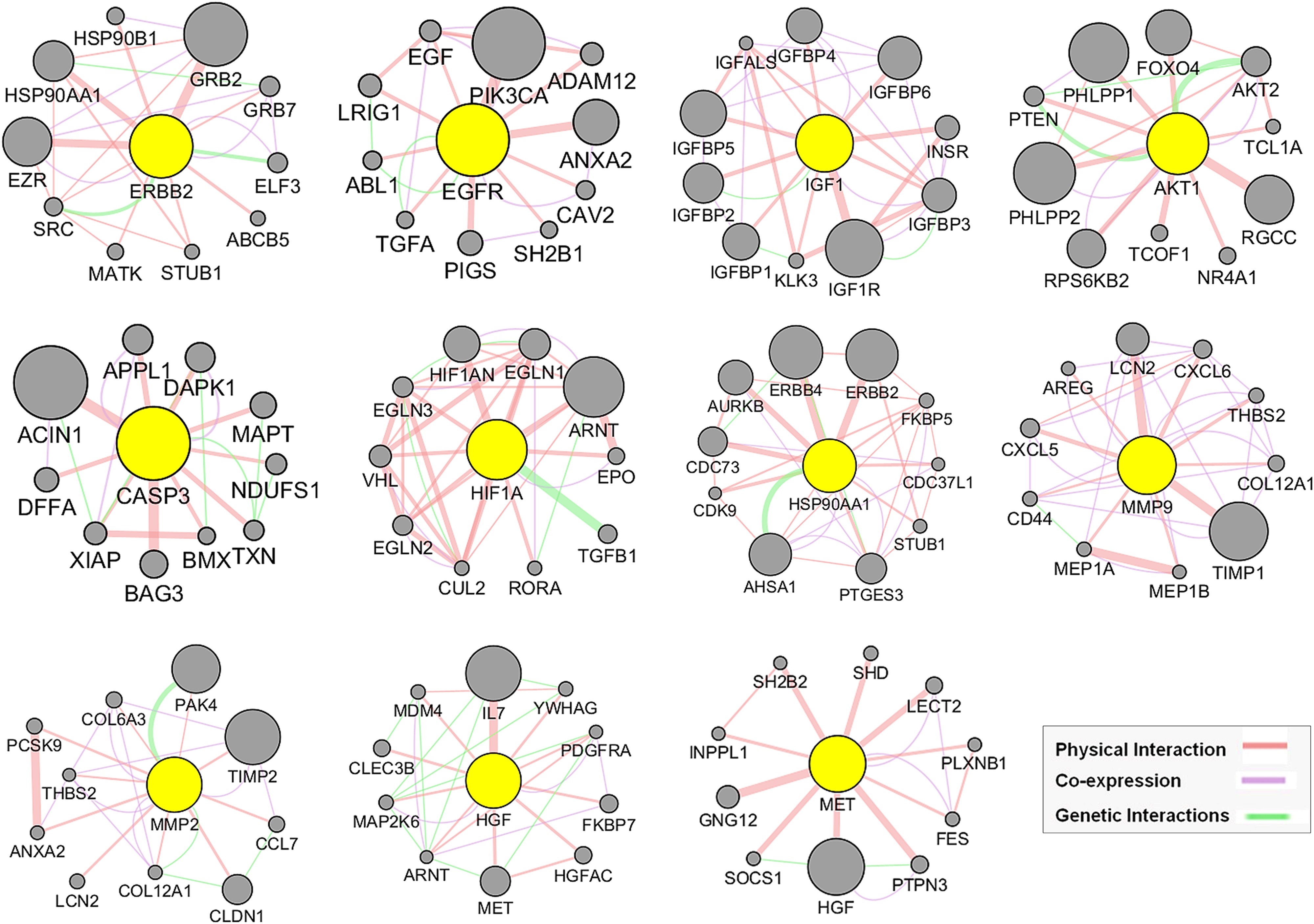
圖7
7、GO和KEGG富集分析、C-T-P網絡構建以及與MAT和mPC相關的GMFA-ED富集比較分析
GMFA-ED數據集揭示了一個擴展的基因網絡,其中包括112個基因,形成了一個功能基因網絡(FGN)(圖8A)。使用DAVID對基因本體論和通路進行了分析。數據庫揭示了BP的顯著富集,包括對mPC進展至關重要的通路,如蛋白激酶B信號轉導、表皮生長因子受體信號轉導、ERK1和ERK2級聯調控以及細胞遷移。此外,與質膜相關的富集CC基底外側質膜和基底質膜等蛋白,強調了它們在癌癥轉移中的相關性。經GMFA-ED分析后富集的中頻蛋白表明,它們與生長因子受體相關的信號轉導密切相關,包括蛋白激酶活性、跨膜受體蛋白酪氨酸、生長因子受體信號轉導和生長因子受體信號轉導。激酶活性、蛋白磷酸酶結合、蛋白酪氨酸激酶活性、胰島素受體底物結合、胰島素樣生長因子結合和胰島素樣生長因子結合(圖8B)。基因組學分析后的KEGG通路分析顯示了mPC相關信號的豐富性,突出了癌癥中的HIF1A、ErbB、FOXO和微陣列等通路。PI3K/Akt信號顯示了廣泛的富集,強調了關鍵的參與者與GMFA-ED分析前相比AT-Targets-Pathways網絡顯示了顯著的相互作用(圖8C)。利用來自GMFA-ED的前20個信號通路構建的MAT-靶標-通路網絡揭示了顯著的相互作用(圖8C)。該網絡有82個節點(MAT、61個靶標和20個通路)和392條邊、表明MAT通過關鍵信號通路中的各種靶點明顯參與(圖8D),包括癌癥中的通路、PI3K/Akt通路、癌癥中的蛋白聚糖、MAPK信號通路,這些發現強調了這些通路在介導MAT對mPC的抗轉移治療效果方面的共同作用。
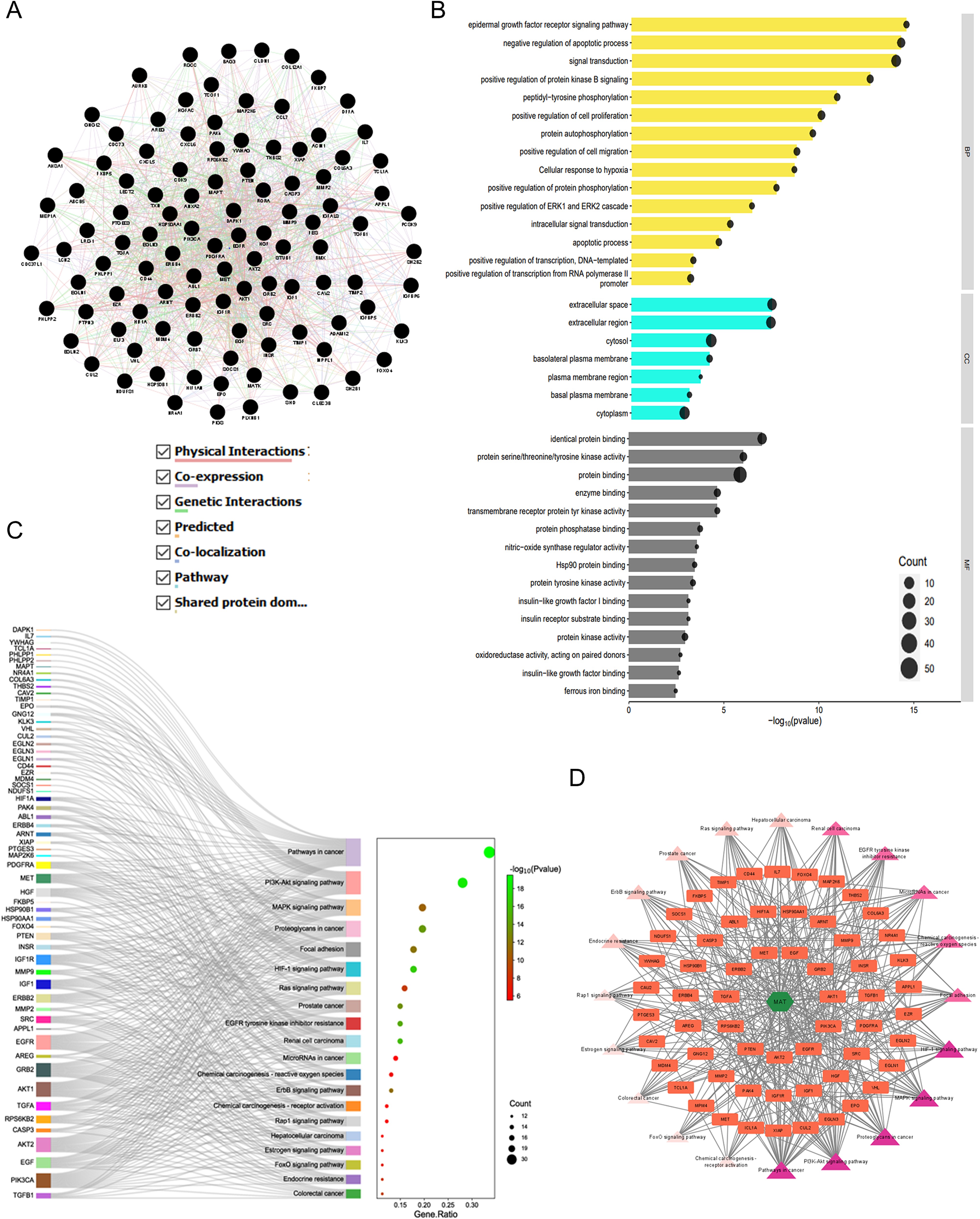
圖8
圖9展示了GMFA實施前后GO和KEGG富集分析的直觀對比(PTM-mPC與GMFA-ED)。GMFA-ED的GO和KEGG富集分析揭示了與MAT對抗mPC的潛在靶點相關的BP、CC和MF的全面富集情況。與最初的樞紐靶標(PTM-mPC)富集相比,這些富集更為相關,有助于深入了解MAT在mPC中潛在抗轉移作用的復雜分子機制。在前列腺癌方面,GMFA-ED富集后的KEGG通路分析確定了PI3K-Akt信號通路中基因的大量富集。值得注意的是,這種富集包括六個基因:GF、GFR、PI3K、Grb2、PTEN和Akt。需要強調的是在對PTM-mPC的初步分析中,除了GF、GFR和Akt外,沒有觀察到MAT的富集作用,而GF、GFR和Akt先前已被確定為MAT的靶點。這強調了通過GMFA-ED分析在揭示PI3K-Akt信號通路參與MAT對前列腺癌的潛在抗轉移作用方面所獲得的更強、更具體的見解(圖10)。
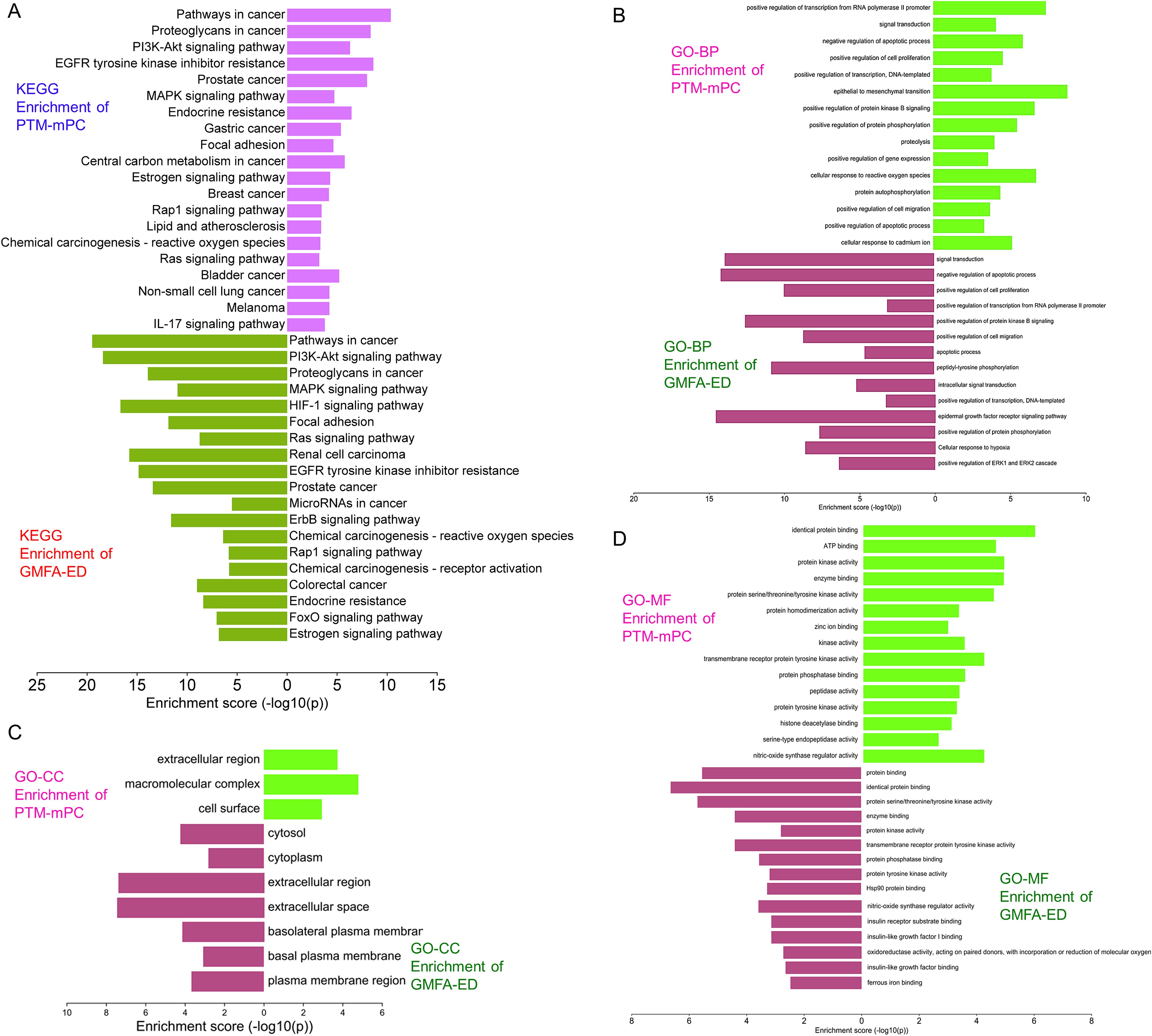

圖9
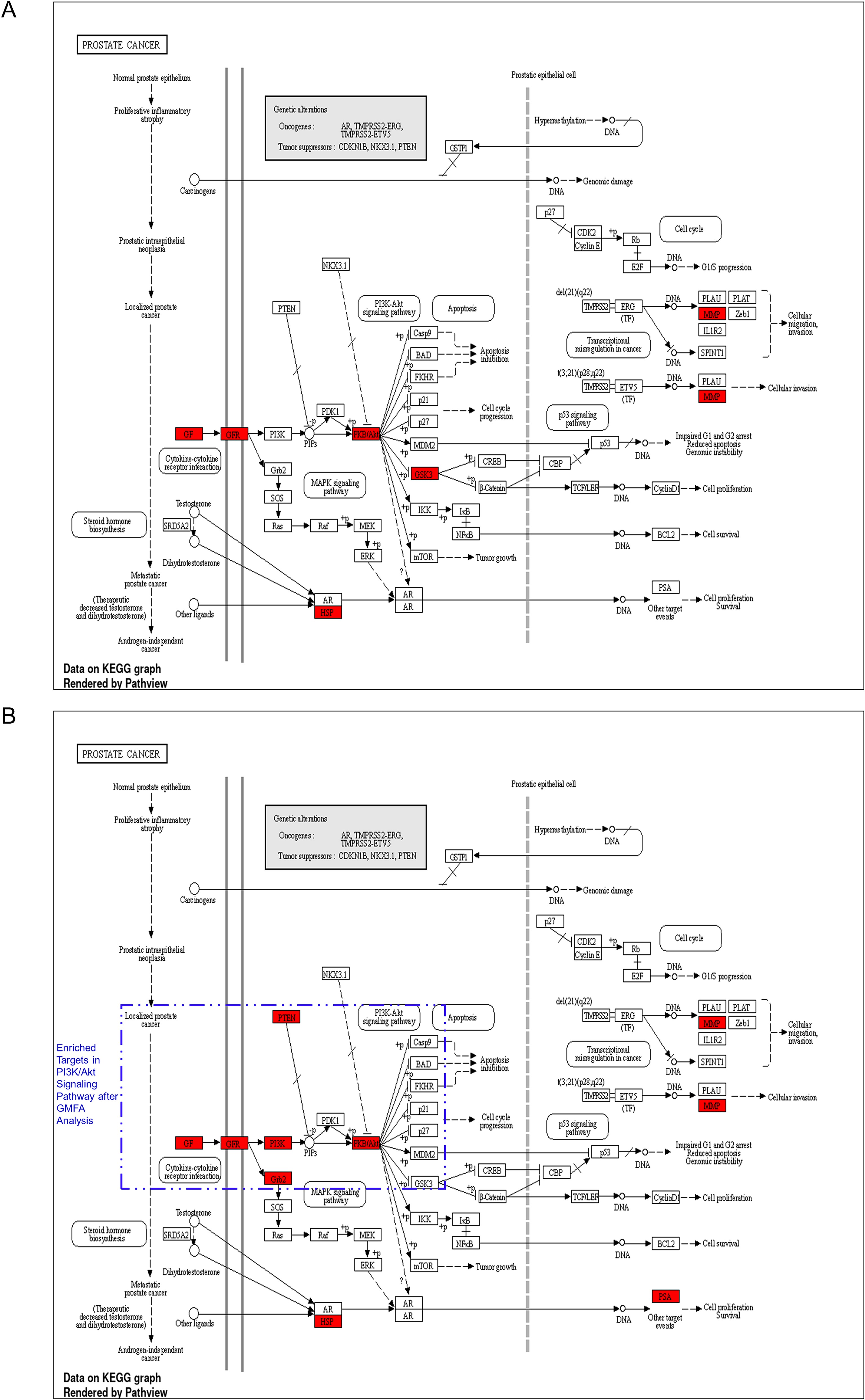
圖10
8、MAT預測的PI3K/AKT信號通路靶標的分子對接和分子動力學模擬研究
作者選擇了在mPC中起關鍵作用的PI3K/Akt信號通路的關鍵成分進行全面的分子對接和模擬研究。由IGF1、HGF和EGF等生長因子引發的PI3K信號激活會導致AKT驅動級聯的下游激活。MAT對PI3K/Akt通路中的成分具有顯著的親和力(圖11),顯示出較低的親和力。與IGF1R(-8.1 kcal/mol)、PI3KCA(-7.5 kcal/-mol)、PTEN(-7.1 kcal/mol)和AKT1的結合能。值得注意的是,PI3K/AKT信號通路中的其他靶點先前也進行了分子對接和MD模擬研究,這是PTM-mPC確定的前10個中心靶點分析的一部分。對接研究中的前三個復合物進行了MD模擬。PI3KCA主干原子的RMSD分析表明,與PI3KCA-CL復合物相比,PI3KCA-MAT復合物的平均RMSD略高于PI3KCA-CL(圖12)。RMSF分析表明,兩種復合物中環路區域(250-500)內殘基的側鏈原子都有明顯波動。MAT始終形成5個一致的氫鍵,而CL形成3個氫鍵,偶爾達到maximum值5個。就IGF1R復合物而言,IGF1R-MAT復合物的RMSD偏差很大,而IGF1RCL復合物的RMSD保持穩定,但略微偏高。兩者的RMSF除了末端殘基和殘基~950-1000。兩種復合物的Rg最初都有偏差,穩定在2.5nm左右。MAT形成了4個穩定的氫鍵,而CL在最初10毫微秒內最多形成5個氫鍵,之后偶爾形成2個氫鍵。在PTEN復合物中,RMSD在50ns后趨于穩定,平均為0.3nm,側鏈原子的波動與apo和PTEN-MAT復合物相似。Rg在最初出現偏差后穩定在2.25nm,MAT在整個過程中偶爾形成2個氫鍵。
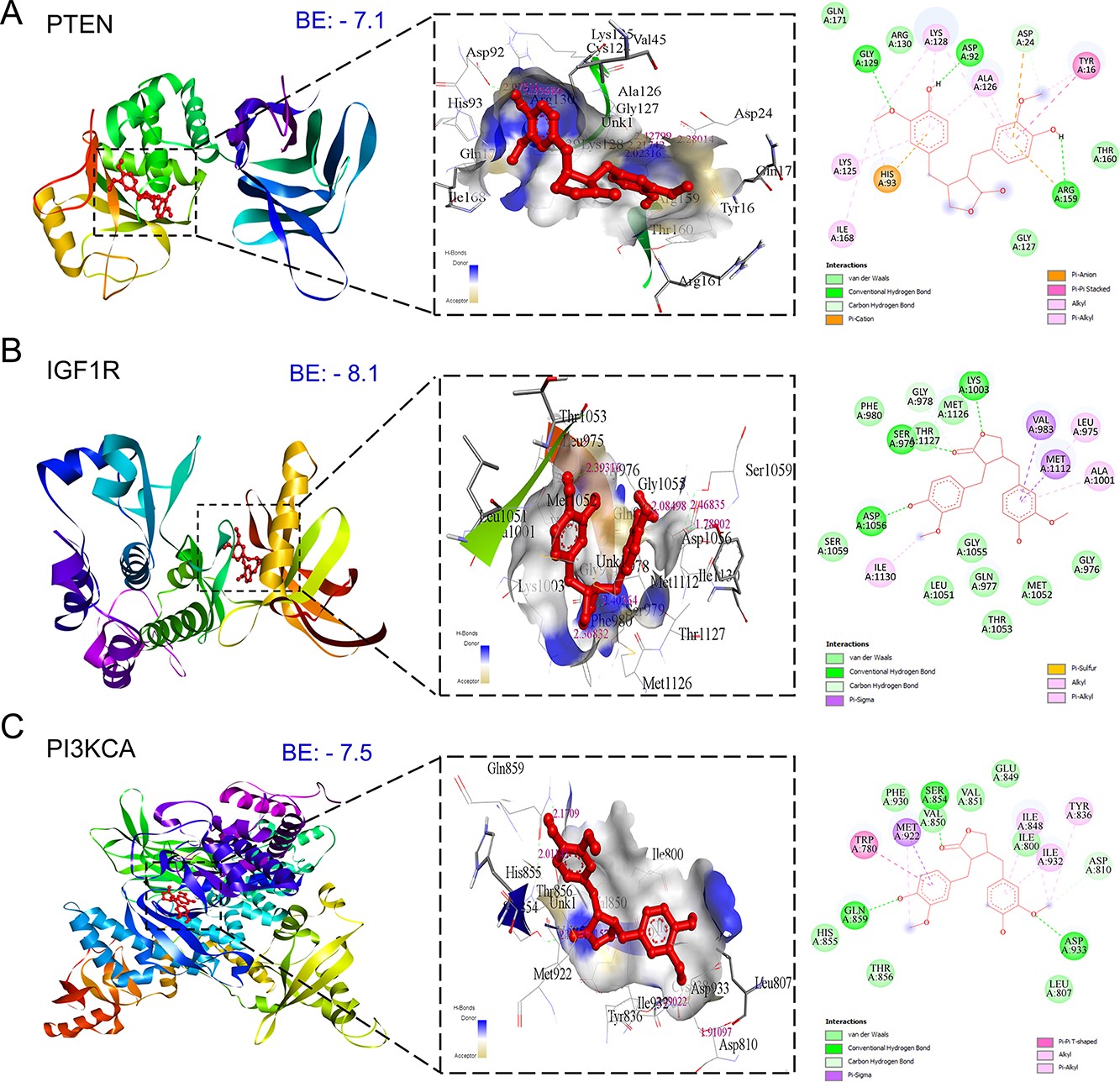
圖11

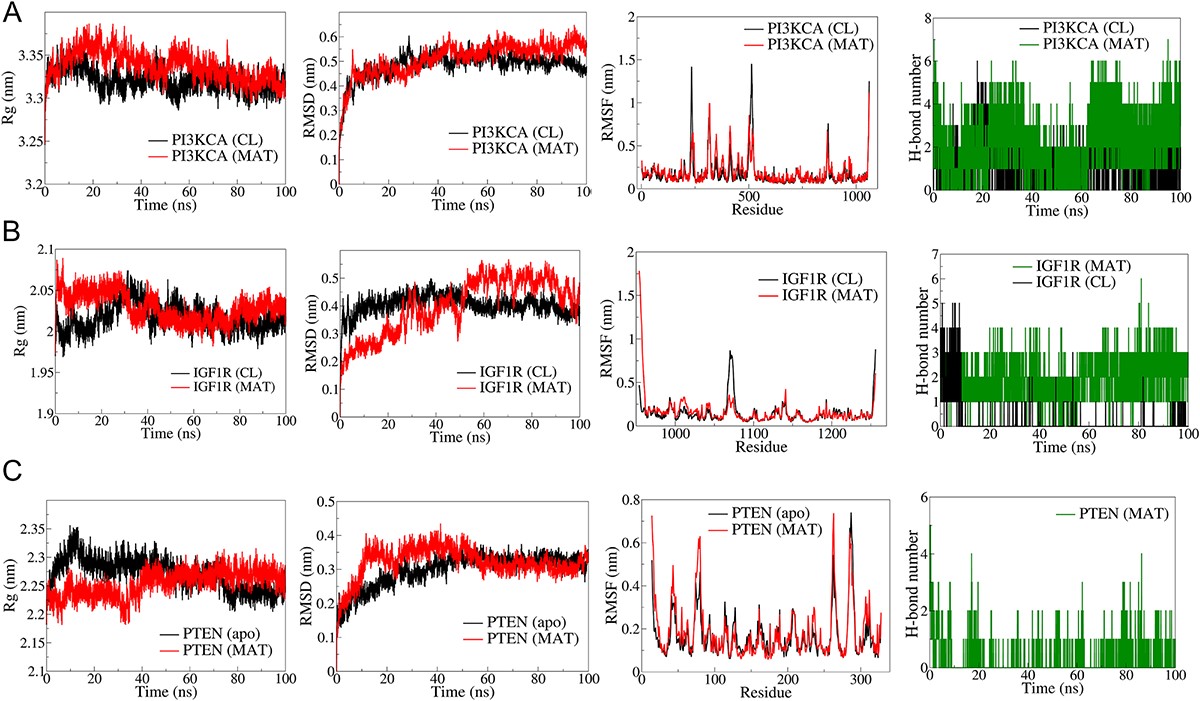
圖12
9、MAT對PC3細胞具有抗癌活性,抑制了PC3細胞的克隆生成能力
MAT對PC3細胞的抗增殖作用是在24、48和72小時內通過MTT試驗進行評估的(圖13A)。在特定時間間隔(24、48和72小時)內,MAT處理后細胞存活率的降低呈劑量依賴性,這證實了MAT對轉移性PC3前列腺癌細胞的抗癌潛力。細胞克隆形成實驗表明,MAT抑制了PC3細胞的克隆生成能力,MAT的影響可直觀地顯示出來(圖13B),隨著MAT濃度的增加,細胞集落和細胞數量減少(圖13C)。定量分析顯示,克隆生成性的降低與劑量有關,MAT劑量為50μM(1.196倍)、100μM(1.44倍)和200μM(2.097倍)時,克隆生成性顯著降低(圖13D)。
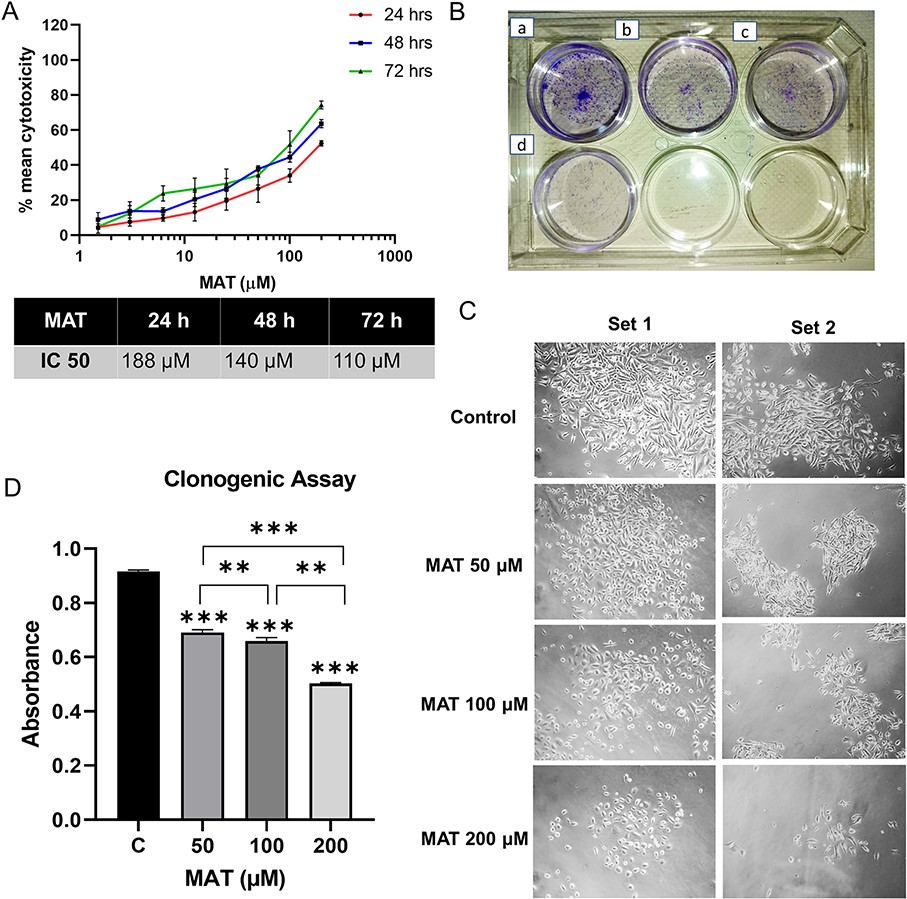
圖13
10、MAT可抑制PC3前列腺癌細胞的遷移,減少基于肌動蛋白的片層和絲狀細胞的形成
傷口愈合試驗評估了PC3細胞的遷移,結果表明MAT處理對細胞遷移的抑制作用呈劑量依賴性(圖14A)。相比之下,50、100和200μM的MAT處理可抑制遷移,使開放傷口面積百分比達到10.99%、經ImageJ軟件分析量化,分別為24.48%和71.33%。位于細胞表面的富含肌動蛋白的結構(即絲狀體和片狀體)通過促進ECM重塑,在轉移過程中發揮著關鍵作用。肌動蛋白細胞骨架的動態協調著細胞的運動和侵襲,對癌癥的轉移級聯起著重要作用。TRITC-鬼筆環肽染色實驗表明,在MAT處理24小時后,絲狀突起和片狀突起的形成明顯減少,且呈劑量依賴性(圖14B)。

圖14
11、通過qPCR分析,MAT在mRNA水平下調了樞紐靶標
MAT處理明顯改變了PC3細胞中關鍵基因的mRNA表達水平(圖15)。值得注意的是,MAT降低了AKT1、ERBB2、MMP2、MMP9、HSP90AA1、HIF1A和IGF1R的mRNA水平、同時增加了PTEN的表達,PTEN是PI3K/AKT信號轉導的調節因子。表皮生長因子受體和METmRNA水平基本不受影響。這些研究結果支持MAT靶向酪氨酸激酶受體,尤其是ERBB2和IGF1R,并調節PI3K/AKT通路,表明它對MMP相關轉移性前列腺癌具有潛在療效。
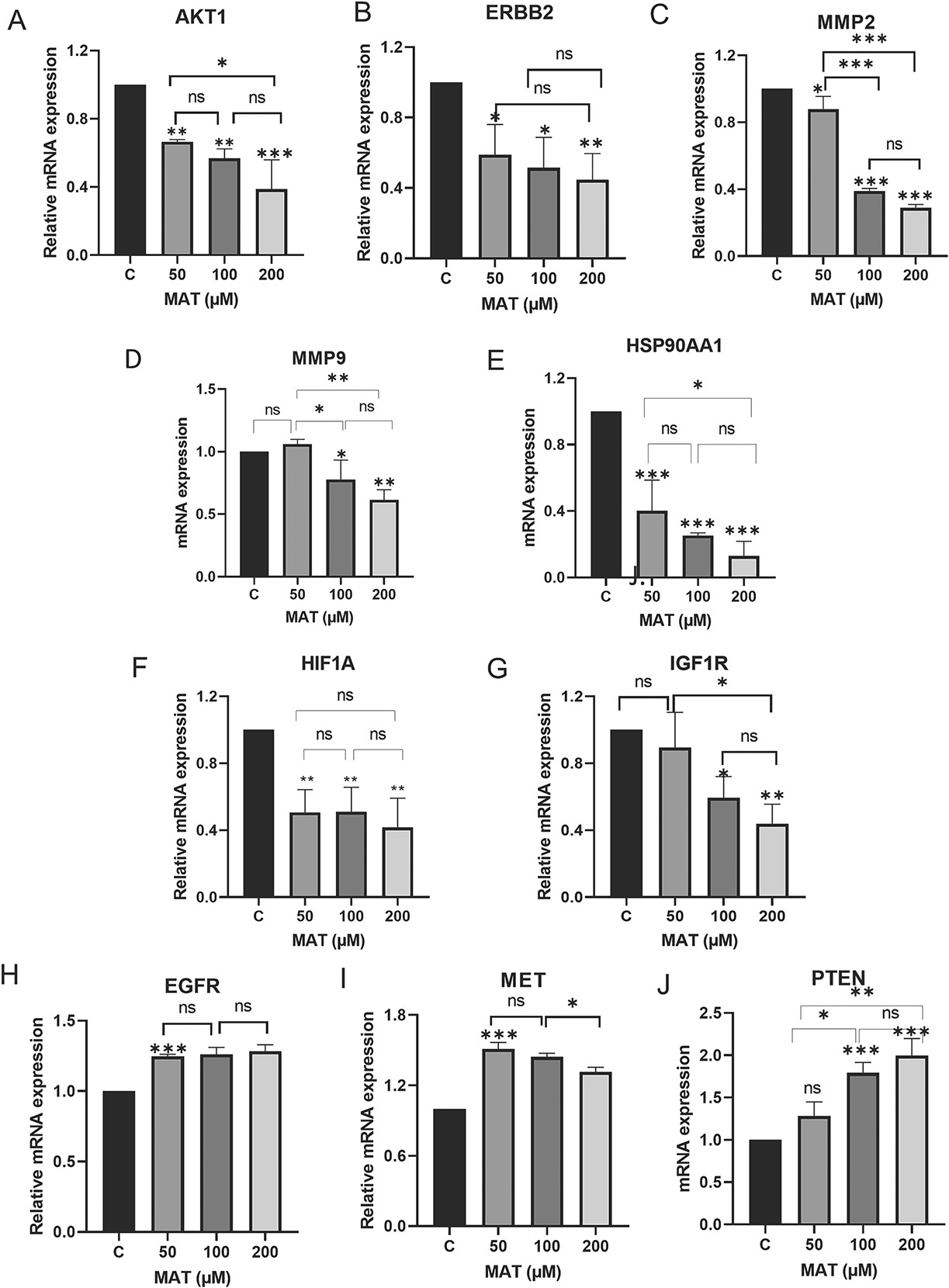

圖15
總結:本文通過網絡藥理學+分子對接+分子動力學模擬+細胞實驗驗證,篩選了MAT針對mPC的治療靶點,闡明了它們在MAT抗mPC轉移潛能中的作用,思路清晰,傲星生物有豐富的分析方案、完善的下游驗證、機制研究服務,一對一專屬服務為您排憂解難,助您輕松應對畢業和晉升!




